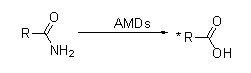
Amidáza (AMD)
Enzymy:Jsou to makromolekulární biologické katalyzátory, většina enzymů jsou proteiny
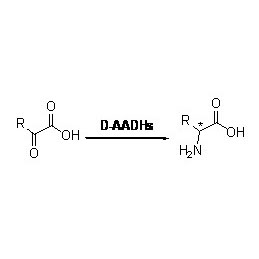
Amidáza:Katalyzujte hydrolýzu různých endogenních a cizích alifatických a aromatických amidů přenosem acylové skupiny do vody za vzniku volných kyselin a amoniaku.Hydroxamové kyseliny a další organické kyseliny jsou široce používány jako léky, protože jsou složkou růstových faktorů, antibiotik a inhibitorů nádorů.Amidázy lze rozdělit na acylázy typu R a typu S podle stereoselektivity katalyzátoru.
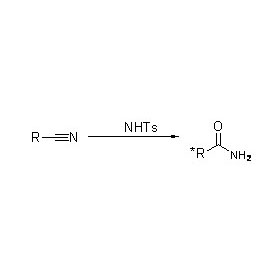
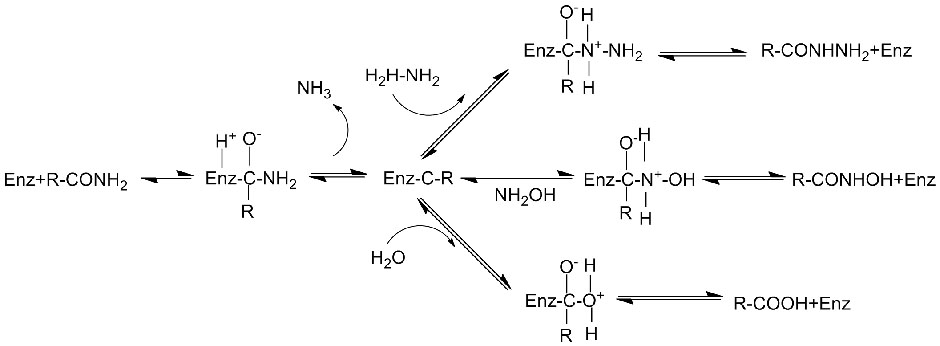
Kromě toho, že katalyzuje hydrolýzu amidů, může amidáza také katalyzovat reakce přenosu acylu v přítomnosti ko-substrátů, jako je hydroxylamin.
Amidázy s různými zdroji mají různou substrátovou specifitu, některé z nich mohou hydrolyzovat pouze aromatické amidy, některé mohou hydrolyzovat pouze alifatické amidy a některé hydrolyzovat α- nebo ω-aminoamidy.Většina aminů má dobrou katalytickou aktivitu pouze pro acyklické nebo jednoduché aromatické amidy, ale pro komplexní aromáty mají heterocyklické amidy, zejména amidy s ortho substituenty, obecně nízkou aktivitu (pouze několik enzymů vykazuje lepší katalytické účinky).
Katalytický mechanismus:
| Enzymy | Kód produktu | Kód produktu |
| Enzymový prášek | ES-AMD-101~ ES-AMD-119 | sada 19 amidáz, 50 mg každá 19 položek * 50 mg / položka nebo jiné množství |
| Screening Kit (SynKit) | ES-AMD-1900 | sada 19 amidáz, 1 mg každá 19 položek * 1 mg / položka |
★ Vysoká substrátová specifita.
★ Silná chirální selektivita.
★ Vysoká účinnost konverze.
★ Méně vedlejších produktů.
★ Mírné reakční podmínky.
★ Šetrné k životnímu prostředí.
➢ Enzymový screening by měl být proveden pro specifické substráty kvůli substrátové specifitě a získat enzym, který katalyzuje cílový substrát s nejlepším katalytickým účinkem.
➢ Nikdy nepřijdete do kontaktu s extrémními podmínkami, jako jsou: vysoká teplota, vysoké/nízké pH a organická rozpouštědla s vysokou koncentrací.
➢ Normálně by měl reakční systém obsahovat substrát, pufrovací roztok (Optimální reakční pH enzymu).V reakčním systému přenosu acylu by měly být přítomny ko-substráty, jako je hydroxylamin.
➢ AMD by mělo být přidáno jako poslední do reakčního systému s optimálním reakčním pH a teplotou.
➢ Všechny druhy AMD mají různé optimální reakční podmínky, takže každý z nich by měl být dále studován samostatně.
Příklad 1(1):
Hydrolytická aktivita na různé amidové substráty
| Podklad | Specifická činnost μmol min-1mg-1 | Podklad | Specifická činnost μmol min-1mg-1 |
| acetamid | 3.8 | ο-OH benzamid | 1.4 |
| propionamid | 3.9 | p-OH benzamid | 1.2 |
| laktamid | 12.8 | ο-NH2benzamid | 1,0 |
| butyramid | 11.9 | p-NH2benzamid | 0,8 |
| Isobutyramid | 26.2 | ο-Toluamid | 0,3 |
| pentanamid | 22.0 | p-Toluamid | 8.1 |
| Hexanamid | 6.4 | Nikotinamid | 1.7 |
| cyklohexanamid | 19.5 | isonikotinamid | 1.8 |
| akrylamid | 10.2 | pikolinamid | 2.1 |
| metakrylamid | 3.5 | 3-fenylpropionamid | 7.6 |
| prolinamid | 3.4 | Indol-3-acetamid | 1.9 |
| benzamid | 6.8 |
Reakce byla prováděna v 50 mM roztoku pufru fosforečnanu sodného, pH 7,5, při 70 °C.
| Amidy | Hydroxylamin | Hydrazin |
| acetamid | 8.4 | 1.4 |
| propionamid | 18.4 | 3.0 |
| Isobutyramid | 25.0 | 22.7 |
| benzamid | 9.2 | 6.1 |
Reakce byla prováděna v 50 mM roztoku pufru fosforečnanu sodného, pH 7,5, při 70 °C.
Koncentrace souvisejícího činidla: amidy, 100 mM (benzamid, 10 mM);hydroxylamin a hydrazin, 400 mM;enzym 0,9 μM.
Příklad 2(2):
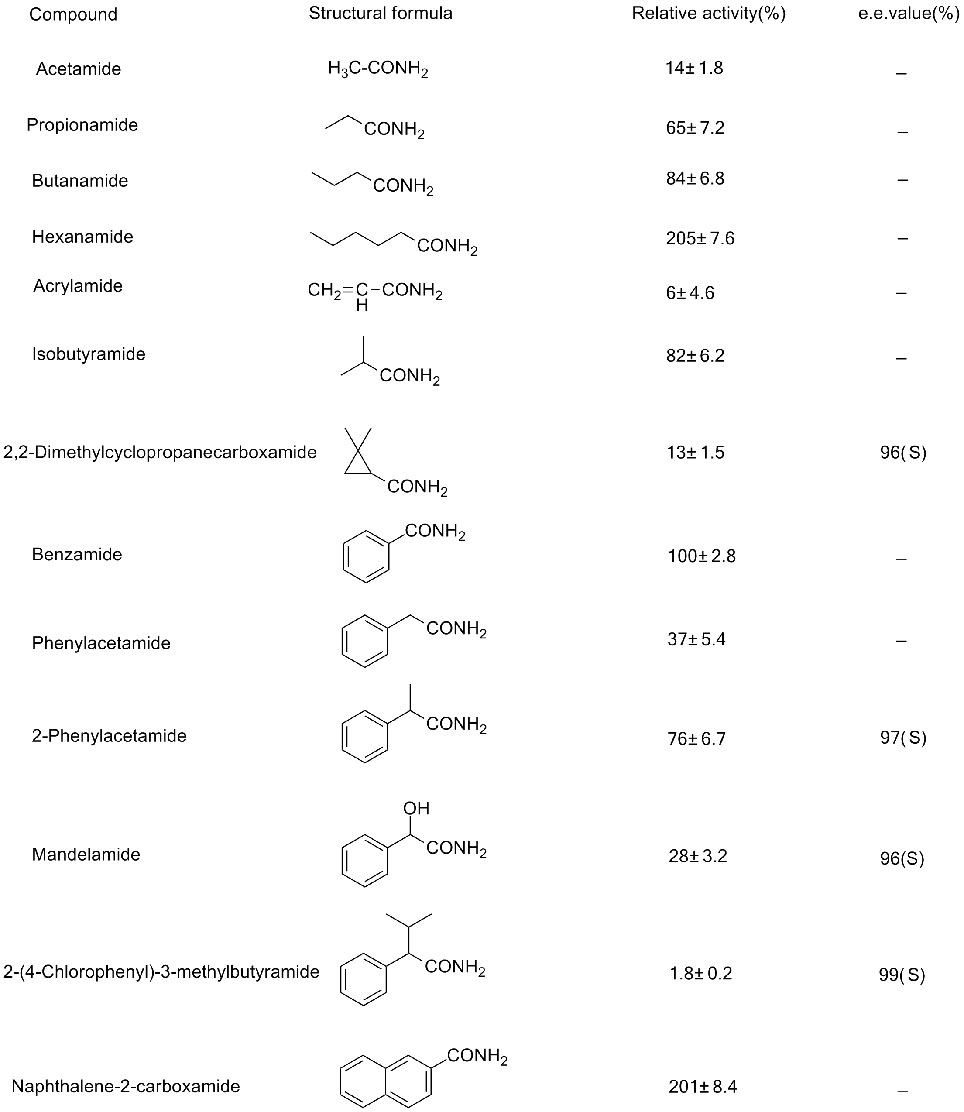
Příklad 3(3):
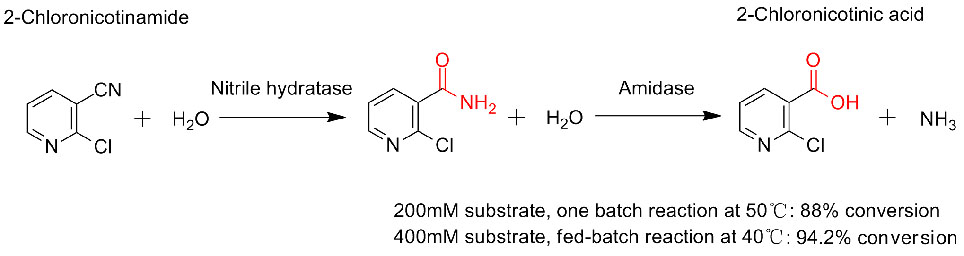
1. D'Abusco AS, Ammendola S., et al.Extremophiles, 2001, 5:183-192.
2. Guo FM, Wu JP, Yang LR a kol.Process Biochemistry, 2015, 50(8): 1400-1404.
3. Zheng RC, Jin JQ, Wu ZM a kol.Bioorganická chemie, 2017, Dostupné online 7.