Imobilizovaný CALB
CALB je imobilizován fyzikální adsorpcí na vysoce hydrofobní pryskyřici, kterou je makroporézní styren/methakrylátový polymer.Imobilizovaný CALB je vhodný pro aplikace v organických rozpouštědlech a bezrozpouštědlových systémech a lze jej za vhodných podmínek po mnoho let recyklovat a znovu používat.
Kód produktu: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★Vyšší aktivita, vyšší chirální selektivita a vyšší stabilita.
★Lepší výkon v nevodných fázích.
★Snadné odstranění z reakčního systému, rychlé ukončení reakcí a vyloučení zbytků bílkovin v produktu.
★ Lze recyklovat a znovu použít ke snížení nákladů.
| Aktivita | ≥10 000 PLU/g |
| Rozsah pH pro reakci | 5-9 |
| Teplotní rozsah pro reakci | 10-60 ℃ |
| Vzhled | CALB-IMMO100-A: Světle žlutá až hnědá pevná látka CALB-IMMO100-B: Bílá až světle hnědá pevná látka |
| Velikost částic | 300-500μm |
| Ztráta sušením při 105℃ | 0,5 %–3,0 % |
| Pryskyřice pro imobilizaci | Makroporézní, styren/methakrylátový polymer |
| Reakční rozpouštědlo | Voda, organické rozpouštědlo atd. nebo bez rozpouštědla.Pro reakci v některých organických rozpouštědlech lze pro zlepšení reakčního účinku přidat 3 % vody |
| Velikost částic | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
Definice jednotky: 1 jednotka odpovídá syntéze 1μmol za minutu propyllaurátu z kyseliny laurové a 1-propanolu při 60 °C.Výše uvedené CALB-IMMP100-A a CALB-IMMO100-B odpovídají imobilizovaným nosičům s různou velikostí částic.
1. Typ reaktoru
Imobilizovaný enzym je použitelný jak v kotlíkovém vsádkovém reaktoru, tak v kontinuálním průtokovém reaktoru s pevným ložem.Je třeba dbát na to, aby nedošlo k rozdrcení v důsledku vnější síly během podávání nebo plnění.
2. pH reakce, teplota a rozpouštědlo
Imobilizovaný enzym by měl být přidán jako poslední po přidání a rozpuštění dalších materiálů a upravení pH.
Pokud spotřeba substrátu nebo tvorba produktu povede ke změně pH během reakce, mělo by být do reakčního systému přidáno dostatečné množství pufru nebo by mělo být pH monitorováno a upravováno během reakce.
V rozsahu teplotní tolerance CALB (pod 60 ℃) se rychlost konverze zvyšovala s rostoucí teplotou.Při praktickém použití by měla být reakční teplota zvolena podle stability substrátu nebo produktu.
Obecně je reakce hydrolýzy esteru vhodná v systému vodné fáze, zatímco reakce syntézy esteru je vhodná v systému organické fáze.Organickým rozpouštědlem může být ethanol, tetrahydrofuran, n-hexan, n-heptan a toluen nebo vhodné směsné rozpouštědlo.Pro reakci v některých organických rozpouštědlech lze pro zlepšení reakčního účinku přidat 3 % vody.
3. Opětovné použití a životnost CALB
Za vhodných reakčních podmínek lze CALB obnovit a znovu použít a konkrétní aplikační doby se u různých projektů liší.
Pokud znovuzískaný CALB není opakovaně používán a je třeba jej po regeneraci skladovat, je třeba jej omýt a vysušit a utěsnit při 2-8 °C.
Po několika kolech opětovného použití, pokud se účinnost reakce mírně sníží, lze vhodně přidat CALB a pokračovat v používání.Pokud je účinnost reakce vážně snížena, je třeba jej vyměnit.
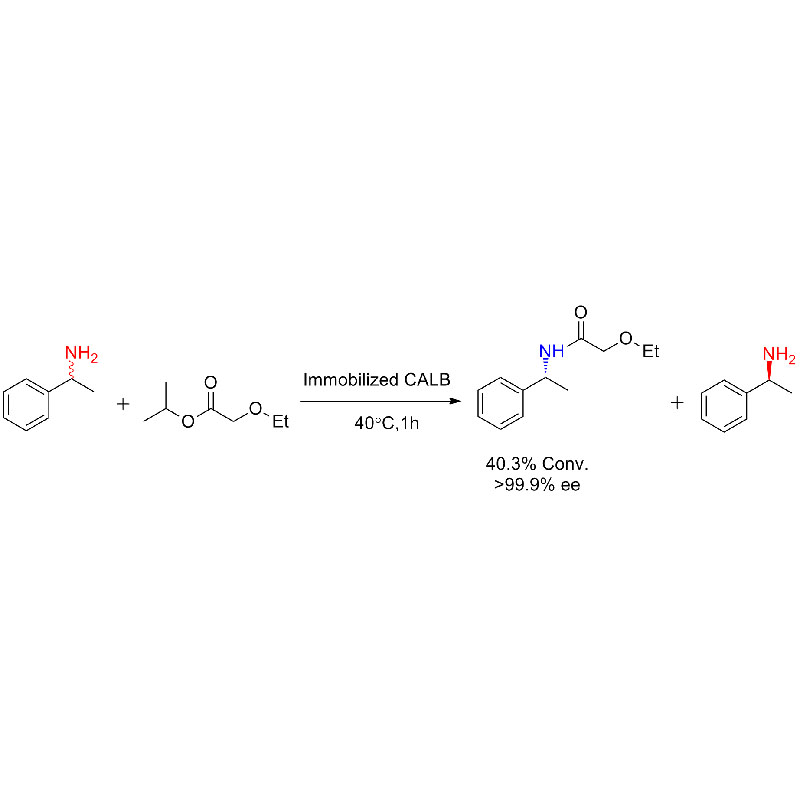
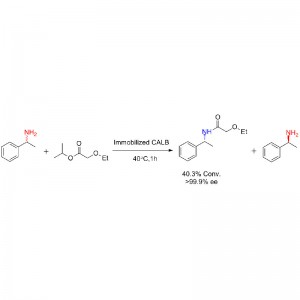
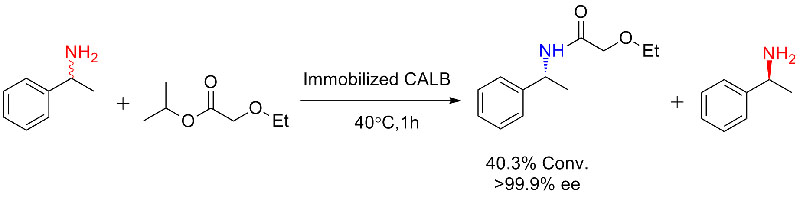
Příklad 1 (aminolýza)(1):
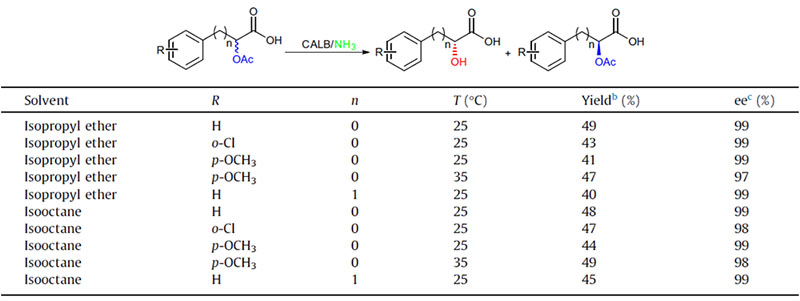
Příklad 2 (aminolýza)(2):
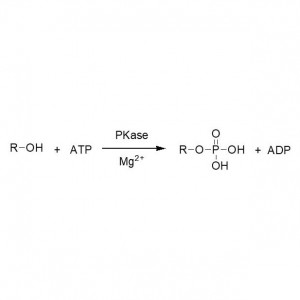
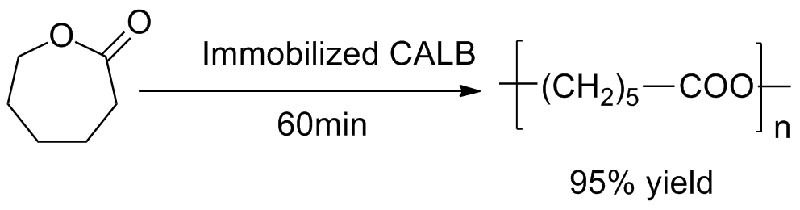
Příklad 3 (syntéza polyesteru s otevřením kruhu)(3):
Příklad 4 (Transesterifikace, regioselektivní pro hydroxylovou skupinu)(4):
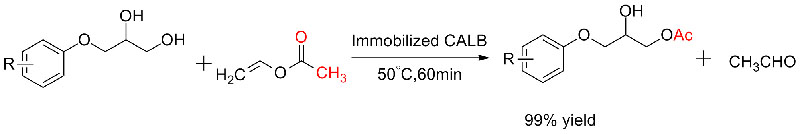
Příklad 5 (transesterifikace, kinetické rozlišení racemických alkoholů)(5):
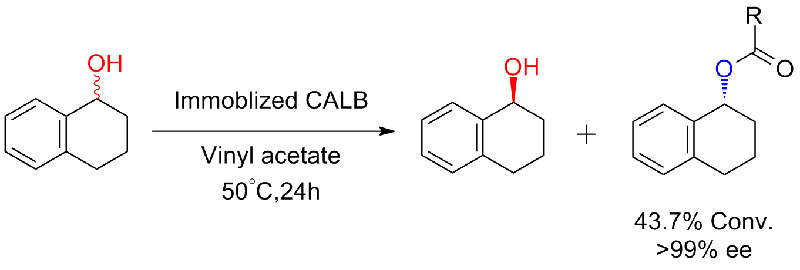
Příklad 6 (Esterifikace, kinetické rozlišení karboxylové kyseliny)(6):
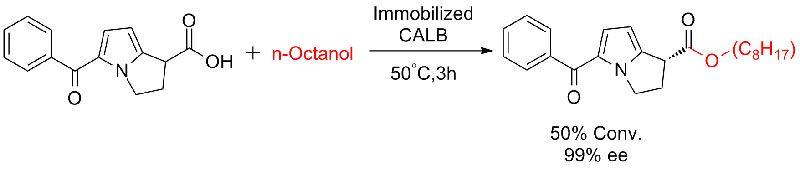
Příklad 7 (Esterolýza, kinetické rozlišení)(7):
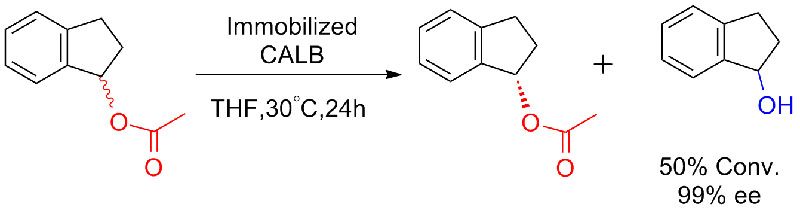
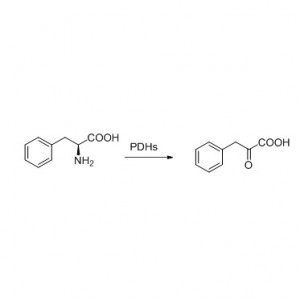
Příklad 8 (Hydrolýza amidů)(8):
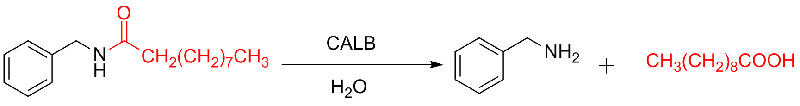
Příklad 9 (Acylace aminů)(9):
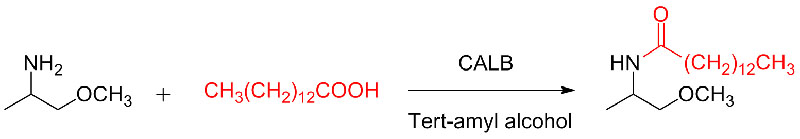

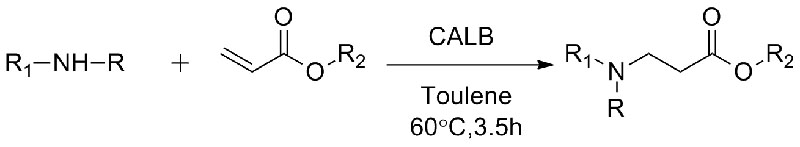
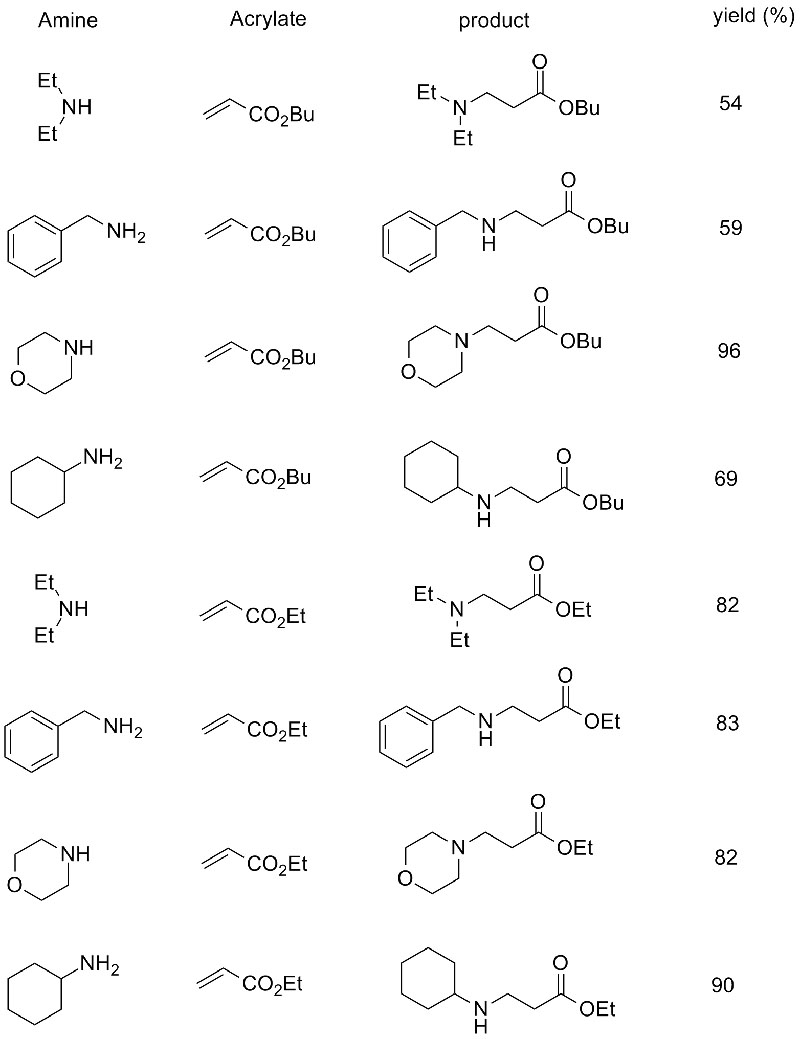
Příklad 10 (Aza-Michaelova adiční reakce)(10):
1. Chen S, Liu F, Zhang K, a kol.Tetrahedron Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, et al.Tetrahedron, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM a kol.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. Eng.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA a spol.J. Mol.Catal.B: Enzym, 2016, 130: 58-69.
8. Gavil´an AT, Castillo E, L´opez-Mungu´AJ Mol.Catal.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N a spol.J. Mol.Catal.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et al.Tetrahedron Lett, 2010, 51: 4455-4458.